近年来,以免疫检查点阻断(ICB)为代表的癌症免疫疗法已经大获成功🤹♂️,并成为未来治疗多种肿瘤的重要基础【1,2】🍷。然而,肿瘤中杀伤性T细胞的系统性缺失以及复杂的肿瘤微环境均会影响免疫治疗效果。因此🍟👩🏿🎤,在临床上急需开发出能有效促进效应T细胞在肿瘤中浸润的新型抗肿瘤药物👮🏽♂️。
ADP核糖基化因子1(Arf1)属于Ras小GTPase家族成员,参与调控机体多种重要的生理过程【3-5】🚂。然而,多项研究表明Arf1在许多人类癌症中都高表达⛸,如肝癌、结肠癌、乳腺癌等❤️🔥。因此,Arf1是一个潜在的肿瘤治疗靶点。然而,目前靶向Arf1的抑制剂普遍存在高毒性和特异性差的缺陷,因此,亟需开发出更加安全有效的新型Arf1抑制剂🍰。
2023年9月6日,侯宪玉教授研究团队在Life Metabolism杂志上发表题为Blockade of Arf1-mediated lipid metabolism in cancers promotes tumor infiltration of cytotoxic T cells via the LPE-PPARγ-NF-κB-CCL5 pathway的研究论文。团队前期研究发现敲除Arf1介导的脂代谢过程能有效杀死肿瘤以及癌症干细胞(CSCs)🤗,并激发抗肿瘤免疫反应【6】🚶🏻➡️。本项研究工作则重点解析了阻断Arf1如何通过影响脂代谢从而促进细胞毒性T淋巴细胞在肿瘤内部浸润,进而诱发抗肿瘤免疫应答的作用机制。这将为高表达Arf1的癌症患者提供一个新的治疗选择,并可能辅助现有的免疫疗法改善患者临床治疗效果。

首先,团队前期研发出的2种新型Arf1抑制剂都能显著增加肿瘤内T细胞的浸润程度,组织RNA测序发现趋化因子与T细胞具有强关联性🫷🏿。通过检测多种趋化因子的表达水平以及肿瘤-免疫细胞共培养系统👧🏽,研究小组发现抑制Arf1主要通过上调CCL5进而影响T细胞的迁移🏄🏽♂️。另外🚉,体内实验也表明CCL5对于Arf1缺失所介导T细胞浸润和抗肿瘤免疫应答至关重要。
接下来为了探究抑制Arf1如何干预CCL5转录的调控机制,团队对 TCGA 数据库中肝癌患者的 RNA 序列数据进行了相关性分析,发现与正常组织相比🦶🏻,过氧化物酶体增殖激活受体γ(PPARγ)信号通路在肿瘤组织中激活程度较低💂🏽♂️,说明激活PPARγ可能有助于抑制肿瘤生长👩🏼⚕️。团队发现🍢,抑制Arf1能激活PPARγ信号通路⬇️,上调其下游基因(CIDEC、FABP4、NR1D1和TXNIP等)的表达水平👼🏿,说明PPARγ被有效激活。PPARγ 是一种转录调节因子【7-9】,可被不饱和脂肪酸活化🏋🏼。通过脂质组学分析👊,研究者发现,阻断Arf1上调了多种不饱和脂肪酸(SUFA)和磷脂酰乙醇胺(PE 18:1)的水平🧕🏿🛂,其中溶血磷脂酰乙醇胺 (LPE)增加最为明显。进一步实验结果显示LPE确实上调了PPARγ信号通路中下游基因的表达水平🟠,说明抑制Arf1可能通过不饱和脂肪酸LPE影响PPARγ的激活🐦。
有研究发现核因子kappa B(NF-κB)是CCL5的主要转录因子【10】。研究团队于是进一步分析了 NF-κB是否参与CCL5 的转录调控👨🏻🦯。首先他们通过western blot和免疫组化(IHC)发现抑制Arf1会增加磷酸化p65的表达水平👨🏼🦲,并且ChIP-qPCR揭示NF-κB蛋白与CCL5启动子区域的结合能力也显著增强🗝。而一旦阻断NF-κB(JSH23)⛺️,Arf1抑制剂通过趋化因子CCL5介导的抗肿瘤免疫效应则被明显抑制➙👩🏼⚕️,说明抑制Arf1可能通过NF-κB-CCL5轴招募T细胞进而发挥抗肿瘤作用。
那么由不跑和脂肪酸LPE激活的PPARγ和NF-κB之间存在何种关联呢🤰?通过免疫共沉淀(Co-IP)实验⚒,研究小组发现LPE能削弱PPARγ和NF-κB的直接结合,而且阻断Arf1结果亦是如此,说明Arf1能够干预两者的相互作用🤾🏻。为了进一步探究PPARγ-NF-κB 是否会对CCL5 转录调控造成影响,研究团队通过凝胶迁移实验(EMSA)观察到迁移条带仅出现在CCL5探针和P65蛋白共孵育的泳道中🙎🏻♂️。而当CCL5 探针与PPARγ 蛋白和 P65 蛋白一起孵育时,则没有检测到迁移的条带🥧,表明 PPARγ 蛋白和 CCL5 探针可能竞争结合P65 蛋白🎋,充分证明了PPARγ-NF-κB-CCL5之间的作用关系🍲。
综上所述🧚🏿♂️,阻断 Arf1 会诱导产生不饱和脂肪酸(LPE),这种脂肪酸能结合 PPARγ 并将其从胞质PPARγ-NF-κB复合体中“夺取”出来。被“释放”的NF-κB发生磷酸化并转运到细胞核中🐭,从而调节趋化因子 CCL5 的转录🧑🦳。CCL5 与细胞毒性T细胞表面的CCR5受体结合进而招募其浸润到肿瘤中去🎙,最终消退肿瘤(图1)。因此🤾🏽♀️,通过阻断Arf1调控LPE-PPARγ-NF-κB-CCL5轴能有效促进杀伤性T 细胞迁移至肿瘤内部从而发挥抗肿瘤作用🤶🏽,这可能为肿瘤免疫疗法提供一种新策略😢🚶♂️➡️。
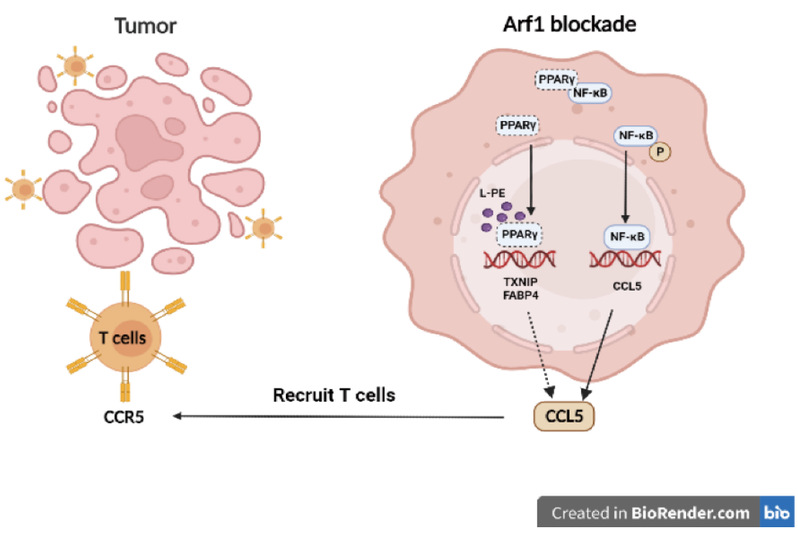
图1. 阻断Arf1介导的脂代谢过程进而诱发抗肿瘤免疫应答的作用机制模式图
杏鑫2019级博士研究生王娜和2021级硕士研究生姚天歌为本文的共同第一作者。杏鑫平台生科院侯宪玉教授和王月桐青年副研究员为本文的共同通讯作者。团队研发的新型Arf1抑制剂目前已申报了PCT国际专利。
原文链接:
https://doi.org/10.1093/lifemeta/load036

